Module de Chimie Générale II
Les exercices I, II, et III sont indépendants.
Exercice I
- On considère une solution aqueuse d’acide nitreux HNO2.
- Ecrire toutes les réactions en solution.
- Ecrire les relations entre les concentrations des différentes espèces en solution.
- Calculer la valeur du pH pour les deux concentrations suivantes : C1 = 10-1 M et C2 = 10-3 M (toute approximation doit être justifiée).
- On considère une solution aqueuse de nitrite de sodium, NaNO2 (sel totalement soluble dans l’eau) de concentration C3 = 10-1 M
- Ecrire toutes les réactions en solution.
- Calculer la valeur de pH de cette solution (toute approximation doit être justifiée).
- Calculer le pH de la solution obtenue en mélangeant 100 mL d’acide nitreux HNO2 de concentration C = 10-1 M et 150 mL de nitrite de sodium NaNO2 de même concentration.
Données : A 25°C, pKe = 14 ; pKa(HNO2/NO2–) = 3,3
Exercice II
La dissolution de Cd(CN)2, sel peu soluble dans l’eau, donne les ions basiques cyanate CN– et les ions cadmium Cd2+.
- Ecrire les réactions chimiques ayant lieu dans une solution contenant un excès de ce sel.
- Etablir l’expression de la solubilité de ce sel en fonction de Ka, Ks et de la concentration en ions H3O+.
- Sans faire de calcul, préciser comment évolue la solubilité s de ce sel lorsque le pH de la solution augmente (justifier votre réponse).
- a- Calculer la valeur du pH à partir de laquelle l’effet du caractère basique des ions CN– devient négligeable.
- Quelle est, dans ce cas, la valeur de la solubilité?
Données : A 25°C : pKs(Cd(CN)2) = 8 ; pKa(HCN/CN–) = 9,3
Exercice III
- On considère à 25°C, la pile construite à partir des deux électrodes suivantes :
- Electrode 1 : une lame de zinc (Zn) plongée dans une solution de nitrate de zinc Zn(NO3)2 de concentration C1 = 10-1M.
- Electrode 2 : une lame d’aluminium (Al) plongée dans une solution de nitrate d’aluminium Al(NO3)3 de concentration C2 = 10-1 M.
- Ecrire pour chaque couple la demi-réaction correspondante.
- Donner l’expression du potentiel de chaque électrode et calculer sa valeur à 25 °C.
- On relie les deux électrodes 1 et 2 pour former une pile.
- Ecrire la réaction qui a lieu lorsque la pile débite (justifier).
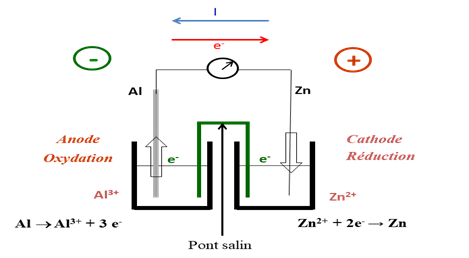
- Faire un schéma clair de la pile en précisant les polarités des électrodes ainsi que le sens de déplacement des électrons et du courant.
- Calculer la f.e.m. E de cette pile.
- Calculer la constante d’équilibre K lorsque la pile est épuisée et commenter la valeur trouvée.
- Déterminer les concentrations des différentes espèces à l’équilibre.
- Peut–on inverser la polarité de la pile de départ par ajout de l’un des ions ? Si oui, lequel ?
Données : A 25°C, (RT/F) ln x = 0,06 log x
π° (Al3+/Al) = -1,66 V ; π° (Zn2+/Zn) = -0,76V
Exercice I 8points
1- a– HNO2 + H2O ⇌ H3O+ + NO2–
2H2O ⇌ H3O+ + OH–
1- b-
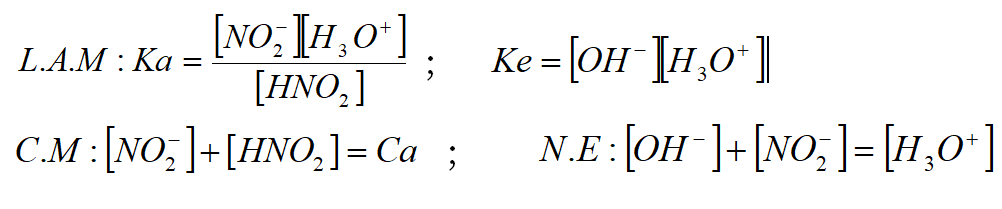
1-c- Ca = C1 = 10-1M : On a une solution d’acide faible.
– milieu supposé assez acide => [OH–] << [H3O+](à vérifier après calcul de pH)
– Ka / C1 = 10-2,3 < 10-2: acide peu ionisé (ou faiblement ionisé)
→
pH < 6, 5 => la 1ère approximation est vérifiée.
pH < pKa -1 = 2,3 => la 2ème approximation est vérifiée. (on fait cette 2° justification si on n’a pas vérifié au départ Ka/C1 < 10-2)
Ca = C2 = 10-3M :
– milieu supposé assez acide [OH–]< < [H3O+],
– Ka / C2 = 0,1 > 10-2 => l’acide n’est pas faiblement ionisé
=> pH = 3,3
pH < 6, 5 => la 1ère approximation est vérifiée.
2-a- NaNO2(s) ⇌ Na+ + NO2–
NO2– + H2O ⇌ HNO2 + OH–
2H2O ⇌ H3O+ + OH–
2-b- C3 = 10-1M :
On a une solution de base faible.
–milieu supposé assez basique => [H3O+] << [OH–] (à vérifier après calcul de pH)
–Kb/C3 = 2.10-11/ 10-1 < 10-2 =>base peu ionisée
→ ph = 8,15
pH > 7, 5 => la 1ère approximation est vérifiée.
pH > pKa +1 = 4,3 =>la 2ème approximation est vérifiée. (on fait cette 2° justification si on n’a pas vérifié au départ Kb / C3 < 10-2)
3- On a un mélange d’un acide faible, HNO2, et d’un sel de sa base conjuguée, NaNO2. Il s’agit donc d’une solution tampon.
pH = 3,48
Exercice II 4,5 points
1- Cd(CN)2(S) ⇌ Cd2+(aq) + 2CN–(aq) (1)
CN– + H2O ⇌ HCN + OH– (2)
2H2O ⇌ H3O+ + OH–
2- Ks = [Cd2+].[CN–]2 ; [Cd2+] = s ; [CN–] + [HCN] = 2s
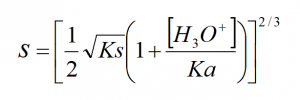
3- pH augmente ó [H3O+] diminue et d’après l’expression précédente, s diminue.
On peu faire un raisonnement qualitatif sur le déplacement d’équilibres : Si pH augmente, c.à.d. [OH–] augmente, l’équilibre (2) se déplace dans le sens de l’augmentation de la quantité de CN–, et par conséquent, l’équilibre (1) se déplace dans le sens de sa consommation qui est le sens de la précipitation => la solubilité s diminue.
4-a- L’effet du caractère acido-basique de l’ion CN– négligeable signifie que CN- se comporte comme un ion indifférent : [H3O+]/Ka << 1 ó [H3O+]/Ka < 0,1
=> pH > pKa + 1 = 10,3.
4-b- Dans ce cas :
Ks = [Cd2+].[CN–]2 ; avec [Cd2+] = s et [CN–] ≈ 2s
Exercice III 7,5 points
A/ 1- Zn2+ + 2e– ⇄ Zn Al3+ + 3e– ⇄ Al
2- Electrode 1 : -0.79 V
Electrode 2 : -1.68 V
B/1- p1 > p2
- Electrode 1 : cathode → réduction: Zn2+ + 2e– ⇄ Zn
Electrode 2 : anode → oxydation : Al ⇄ Al3+ + 3e–
- la réaction qui a lieu : 2Al + 3Zn2+ → 3Zn + 2Al3+
2-
4-
Constante d’équilibre très élevée => réaction totale.
5– 2Al + 3Zn2+ → 3Zn + 2Al3+ t=0 0,1M 0,1M
téq 0,1-3x 0,1+2x
La réaction est totale =>0,1-3x = 0 => x = 0,033M
[Al3+] = 0,166M
[Zn2+] = 3,02.10-31 M
6. il faut augmenter la concentration en Al3+ dans la solution de l’électrode 2.
Rq : Dans la pratique ceci n’est pas possible car la concentration en Al3+sera très élevée puisque la constante d’équilibre est très grande.
